
On a retrouvé le #coronavirus dans les #eaux #usées, et cela pourrait nous aider à mieux #suivre l’épidémie
Derrick Ceyrac/AFP
Vincent Marechal, Sorbonne Université
L’épidémie de Covid-19, due au coronavirus SARS-CoV-2, impressionne à la fois par la rapidité de circulation du virus depuis décembre 2019 et par le nombre de cas rapportés : lorsque l’Organisation mondiale de la Santé a officiellement déclaré l’état de pandémie, le 12 mars 2020, 125 260 cas avaient été confirmés. Un mois et demi plus tard, le 22 avril, plus de 2,5 millions de cas confirmés étaient dénombrés.
L’émergence de ce virus n’est pas sans rappeler celle du SARS-CoV, virus de la même famille à l’origine de l’épidémie de SRAS (syndrome respiratoire aigu sévère) entre novembre 2002 et juillet 2003. Celle-ci a été éradiquée en quelques mois seulement, non sans avoir touché près de 8000 personnes et fait 800 victimes dans 26 pays.
Comparer les épidémies de SRAS et de Covid-19 est particulièrement informatif si l’on considère que les deux virus qui en sont à l’origine présentent de nombreux caractères communs et qu’ils sont assez proches génétiquement. Mais les mesures qui avaient permis d’endiguer l’épidémie de SRAS – détection précoce et isolement des cas, mise en quarantaine des contacts, distanciation sociale et dans certains cas quarantaine collective – se sont avérées insuffisantes à ce jour pour contrôler la circulation du nouveau coronavirus.
SRAS et Covid-19 : deux différences majeures
Au moins deux facteurs importants distinguent les épidémies de SRAS et de Covid-19.
Dans le cas du SRAS, l’excrétion du virus par les personnes infectées, essentielle à sa transmission, suivait l’apparition des signes cliniques. Cette caractéristique a permis d’identifier et d’isoler rapidement les malades (fièvre, syndromes respiratoires) et de mettre en quarantaine les personnes avec lesquelles ils étaient entrés en contact, avant qu’ils ne transmettent le virus. À l’opposé, pour le Covid-19, l’excrétion virale pourrait précéder l’apparition des symptômes, rendant la transmission possible avant même que les malades ne soient identifiés et donc isolés.
Par ailleurs, si des formes cliniques peu sévères et l’existence de porteurs sains ont été rapportées lors de l’épidémie de SRAS, il semblerait que ces personnes n’aient pas transmis le virus de façon significative. Dans le cas du Covid-19, les sujets non symptomatiques, en phase d’incubation ou peu symptomatiques – dans des proportions qui restent encore à préciser – pourraient transmettre le virus.
Détecter les porteurs peu ou non symptomatiques
Les porteurs silencieux-contagieux sont difficiles à identifier hors de campagnes massives de dépistage. Cependant, ils pourraient introduire le virus dans les populations indemnes et contribuer à la dissémination silencieuse du virus en phase épidémique.
Les tests virologiques (appelés tests directs) utilisés pour identifier les porteurs du virus reposent actuellement sur des prélèvements réalisés dans le nez à l’aide d’un écouvillon. Les échantillons sont traités afin d’extraire et de détecter le génome viral, constitué d’un ARN simple brin. Cet ARN est ensuite utilisé pour obtenir l’ADN correspondant, grâce à une enzyme qui produit de l’ADN à partir d’ARN. Cet ADN est ensuite amplifié grâce à une autre enzyme (par PCR – Polymerase Chain Reaction).
À lire aussi :
Covid-19 : comment fonctionnent les tests et quelles sont leurs utilités ?
Cette technique, appelée RT-PCR (Reverse Transcription PCR), est remarquablement sensible. Néanmoins, le résultat de cette analyse peut être négatif pour plusieurs raisons. Le sujet peut ne pas être infecté : il s’agit dans ce cas d’un vrai résultat négatif. Mais il peut aussi arriver que des faux négatifs soient obtenus, alors que la personne testée est bien infectée. En effet, il se peut que le prélèvement et/ou la RT-PCR ne soient pas réalisés de façon optimale. Autre possibilité : le sujet est effectivement infecté, cependant le virus n’est que peu ou pas présent dans le nez au moment du prélèvement, mais se trouve à ce moment dans d’autres sites anatomiques, tels que les selles ou le sang. Cette situation est envisageable si le virus migre dans l’organisme à mesure que l’infection évolue, par exemple.
Il semblerait que, pour le coronavirus SARS-CoV-2, ce cas de figure s’applique. En effet, si le cycle biologique du virus débute et se déroule pour partie dans les voies respiratoires supérieures et inférieures – les poumons notamment –, plusieurs études ont aussi détecté des traces du virus dans le sang et, surtout, dans les selles. La présence de virus dans le tube digestif est compatible avec la description de troubles gastro-intestinaux durant la maladie chez certains patients.
Cette découverte pose bien entendu la question d’une possible transmission par voie fécale, non formellement établie à ce jour. Mais elle a d’autres implications.
En l’absence d’un dépistage systématique, massif et répété, pour identifier les porteurs du virus, il est urgent de proposer d’autres indicateurs fiables qui permettraient d’évaluer aussi précocement que possible l’entrée et le niveau de circulation du virus dans les populations. Pour être déployés à l’échelle mondiale, y compris dans les pays à faibles revenus, ces indicateurs doivent être faciles à mettre en place, éthiquement acceptables et financièrement soutenables.
Des tests menés sur les eaux usées pourraient correspondre à ces critères.
Le virus détectable dans les eaux usées
La détection du coronavirus dans les selles a incité plusieurs groupes à travers le monde à promouvoir l’analyse des eaux usées pour évaluer sa circulation dans les populations.
Les eaux usées correspondent en effet à l’ensemble des eaux issues des habitations et des équipements publics urbains (hôpitaux, écoles…) ainsi que de certaines industries (si elles ne nécessitent pas de traitement spécifique). Ces eaux sont acheminées, via le « tout à l’égout », vers les stations d’épuration ; elles y sont traitées puis rejetées dans l’environnement.
Certains réseaux sont dits « unitaires » – les eaux pluviales et les eaux usées sont mélangées – tandis que d’autres sont « séparatifs » – eaux pluviales et eaux usées ont chacune leur propre réseau. Il arrive que lors d’évènements climatiques exceptionnels (pluies abondantes ou orages violents), certains réseaux débordent et entraînent une dégradation du milieu, qui peut-être non seulement chimique, mais aussi microbiologique. Il est néanmoins essentiel de rappeler ici que les réseaux d’eaux usées et d’eaux non potables sont totalement distincts des réseaux de distribution d’eau potable, dont la qualité microbiologique et chimique est étroitement surveillée.
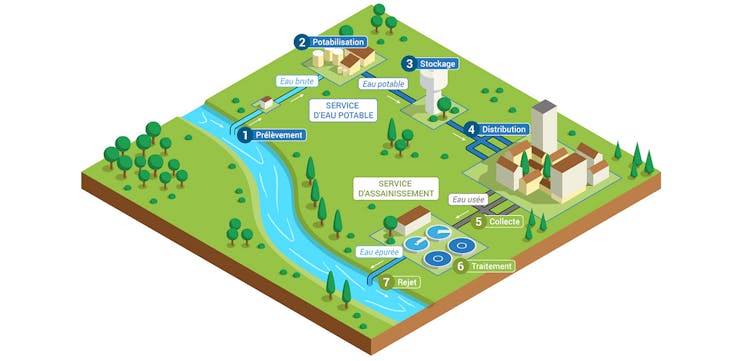
EauFrance
Une spécificité parisienne, bien connue, concerne la présence d’un réseau d’eau dit « non potable » dont le rôle est de permettre le nettoyage de la chaussée, des égouts ou le remplissage de différents lacs ornementaux. Ce réseau est directement alimenté par de l’eau de surface puisée dans le canal de l’Ourcq ou la Seine, une eau non potable dans laquelle des traces d’ARN viral ont récemment été détectées, en très faible quantité toutefois.
Selon leur taille, les stations d’épuration peuvent collecter les selles de quelques centaines à plusieurs millions de personnes ; par conséquent, les eaux usées qui en sont issues reflètent partiellement la diversité des micro-organismes hébergés dans nos intestins, à l’échelle d’une agglomération.
De premiers résultats de recherche
Une première étude, réalisée par Gertjan Medema et ses collaborateurs aux Pays-Bas, a démontré que le génome du coronavirus peut être détecté dans plusieurs sites de prélèvement d’eaux usées quelques jours seulement après l’identification du premier cas humain de Covid-19 dans ce pays. Une étude similaire a été conduite dans le Massachusetts (USA).
L’étude initiée depuis le 5 mars 2020 en région Ile-de-France, sur 3 sites de prélèvement d’eaux usées, confirme cette hypothèse. Elle démontre également, pour la première fois, que les quantités de génomes viraux détectés dans les eaux usées augmentent en phase avec le nombre d’hospitalisations liées au Covid-19 au niveau régional. Des résultats préliminaires obtenus plus récemment encore sur les mêmes sites montrent une réduction très significative de la charge virale dans les eaux usées, une conséquence attendue des mesures de confinement sur la circulation du virus.
Ces résultats nous incitent aujourd’hui à proposer une surveillance régulière des eaux usées.
Ce que le « macrobiote collectif » pourrait nous dire
Si l’enrichissement des eaux usées en coronavirus est dû à des porteurs peu ou pas symptomatiques – les plus nombreux – la recherche régulière et systématique du virus sur ces échantillons pourrait permettre d’exercer une veille essentielle et complémentaire des approches épidémiologiques chez l’être humain (comptage des cas symptomatiques – confirmés ou supposés – et recherche du virus chez les sujets malades et leurs contacts notamment par RT-PCR).
Cette stratégie pourrait être implémentée dans un plan de lutte intégré contre l’épidémie. Elle pourrait notamment être déployée en priorité dans les régions – en France comme à l’étranger – dans lesquelles la prévalence du virus est encore très faible (peu de cas rapportés) voire nulle, en complément des études épidémiologiques conduites chez les populations. Elle pourrait également nous informer d’une modification dans la dynamique de circulation du virus : réduction de la circulation liée au confinement par exemple, reprise de l’épidémie – souvent désignée comme une « deuxième vague » – signal de réintroduction dans une région ou l’épidémie semblait sous contrôle, pour ne citer que quelques exemples.
À terme, la situation actuelle et les recherches en cours soulignent l’urgence d’un réseau national de surveillance des eaux usées dont le bénéfice pourrait être évalué à l’occasion du suivi de l’épidémie en cours (participation à la stratégie de déconfinement et appréhension d’une éventuelle seconde vague notamment), et plus généralement dans le suivi de tous les germes à circulation fécale – virus des gastro-entérites hivernales, bactéries multirésistantes aux antibiotiques, etc.
Les acteurs en charge de l’assainissement en France sont d’ores et déjà organisés pour suivre la qualité des effluents alimentant leurs installations. Cette organisation permettrait d’utiliser les installations existantes pour mettre en place un suivi très rapidement.
Enfin, nous pourrions ainsi imaginer, dans un futur proche, utiliser les eaux usées pour évaluer la santé d’un « macrobiote collectif » qui ferait écho aux microbiotes intestinaux individuels, dont l’importance en santé humaine n’est aujourd’hui plus à démontrer.
Sébastien Wurtzer (Eau de Paris), Jean‑Marie Mouchel (Sorbonne Université), Rémy Teyssou (Institut de recherche biomédicale des armées), Yvon Maday (Sorbonne Université, co-fondateur de l’initiative Covid-IA), Vincent Rocher (SIAAP) et Laurent Moulin (Eau de Paris) sont co-auteurs de cet article.![]()
Vincent Marechal, Professeur de virologie, Centre de Recherche Saint Antoine (Inserm), Sorbonne Université
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.





