#Variole du #singe : « Cette circulation de la maladie est complètement nouvelle »
Camille Besombes, Institut Pasteur et Arnaud Fontanet, Conservatoire national des arts et métiers (CNAM)
Depuis le début du mois de mai, plus d’une centaine de cas suspects de variole du singe, maladie originaire d’Afrique, ont été détectés dans plusieurs pays européens ainsi qu’en Amérique du Nord, en Australie, et en Israël. Quel est ce virus ? Qui est concerné ? Faut-il s’inquiéter de cette flambée de cas ? Engagés depuis 3 ans dans le projet Afripox, qui vise à mieux comprendre la variole du singe dans sa région d’émergence, Camille Besombes, médecin infectiologue et doctorante dans l’unité d’Arnaud Fontanet, coordinateur du projet, fait le point.
The Conversation : Qu’est-ce que le virus de la variole du singe, ou monkeypox ?
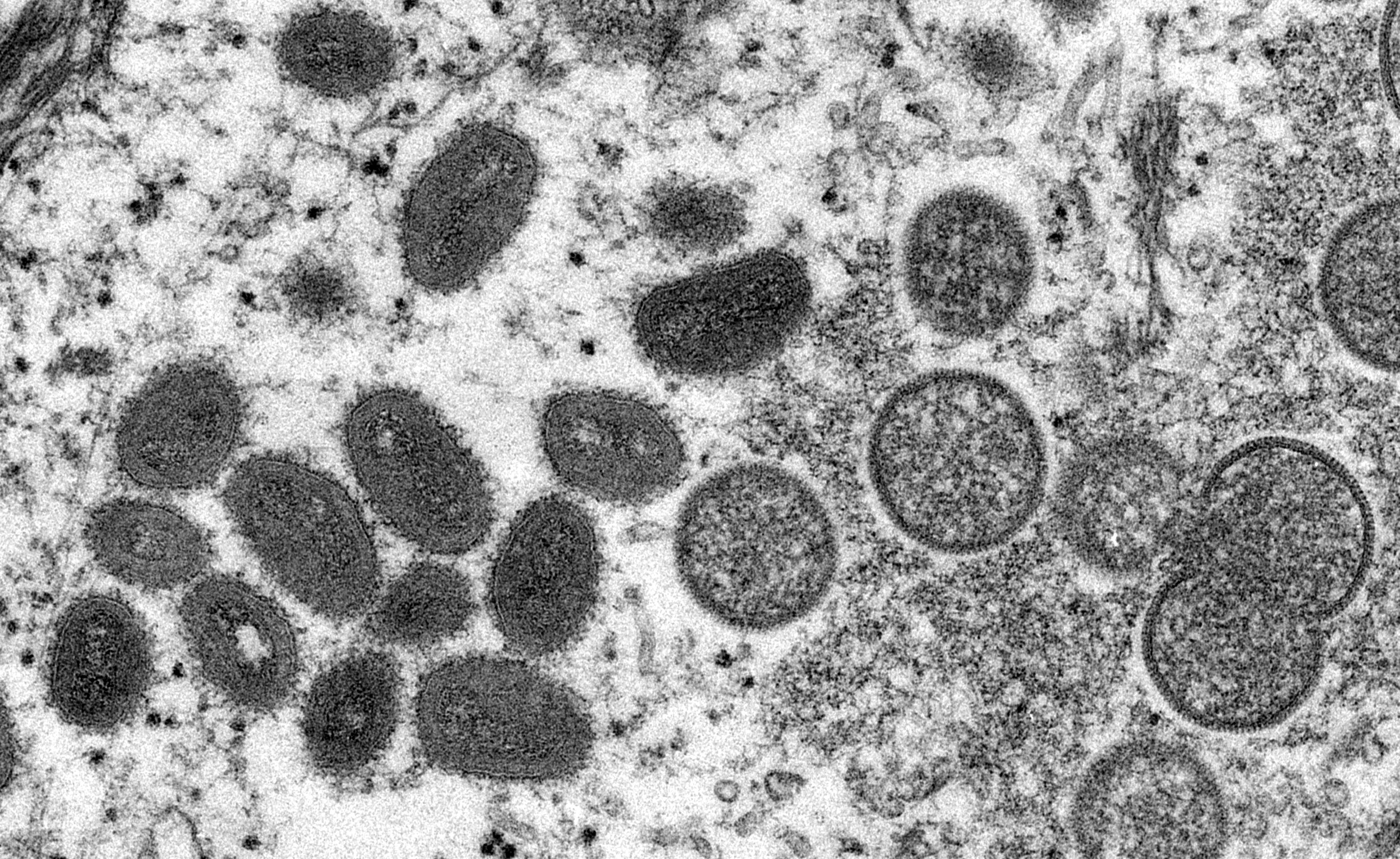
Camille Besombes : Le virus de la variole du singe (« monkeypox » en anglais) appartient au genre des Orthopoxvirus, auquel appartient le virus de la variole. Il s’agit d’un gros virus à ADN qui présente une appétence particulière pour les tissus cutanés. Cependant, à la différence du virus de la variole, qui n’infectait que les humains et a ainsi pu être éradiqué suite à la vaccination massive de la population mondiale, le monkeypox a un réservoir animal. Et contrairement à ce que l’on pourrait croire, ce réservoir n’est pas le singe.
En effet, si le monkeypox doit son nom au fait d’avoir été isolé pour la première fois chez des primates captifs (en 1958 au Danemark), son réservoir serait en réalité un rongeur ou un écureuil. Le premier cas humain d’infection par le monkeypox, un enfant de 9 mois, a été détecté en 1970, en République démocratique du Congo, dans le cadre du renforcement de la campagne d’éradication de la variole.
On connaît à l’heure actuelle deux souches de virus monkeypox. La souche dite « Afrique de l’ouest », dont la létalité se situe aux alentours de 1 %, sévit au Nigéria, au Libéria, en Sierra Leone, en Côte d’Ivoire. C’est cette souche qui est impliquée dans les cas détectés actuellement en Europe. La seconde souche, dite « du bassin du Congo », circule en République démocratique du Congo (RDC), en République du Congo, en République centrafricaine (RCA), au Gabon et également au Cameroun (ce pays est situé à la limite des aires de répartition des deux souches, et des cas issus du Nigéria y ont récemment été décrits). Associée à des formes cliniques plus sévères, la souche « bassin du Congo » a une létalité de 10 %.
Rappelons cependant que ces chiffres concernent des pays où, malheureusement, la prise en charge médicale des patients est difficile dans les régions les plus reculées. Actuellement, une dizaine de patients sont hospitalisés, pour certains afin de mieux les isoler, mais aucune forme sévère n’a été recensée en Europe.
TC : Quels sont les symptômes de la maladie ?
CB : Après une période d’incubation relativement longue (de 6 à 13 jours, voire jusqu’à 21 jours), la maladie débute par deux jours de « prodromes », des symptômes avant-coureurs de la maladie : une fièvre pouvant être élevée, des maux de tête, une augmentation du volume des ganglions lymphatiques (ce qui est un signe différentiel avec la variole), des douleurs musculaires, de la fatigue… On considère les patients contagieux dès cette phase.
Jean Marc Zokoé, Fourni par l’auteur
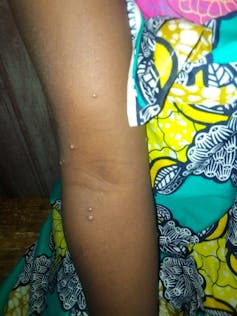
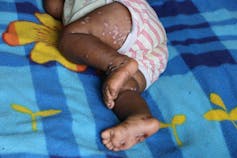
Des éruptions cutanées surviennent ensuite, souvent sur le visage dans un premier temps. Elles s’étendent progressivement au reste du corps. Cette atteinte cutanée est douloureuse à cause de l’inflammation provoquée autour des lésions, de plus il y a des démangeaisons importantes. Dans le cas de la souche d’Afrique de l’Ouest, ces lésions peuvent être initialement rares et discrètes, et donc potentiellement passer inaperçues. La maladie dure typiquement de 2 à 4 semaines, et se résout spontanément dans la majorité des cas.
Les principales complications sont la survenue d’une déshydratation, à cause des pertes d’eau qui surviennent quand les lésions sont nombreuses et étendues, la surinfection bactérienne des dites lésions et des septicémies, ainsi que des lésions oculaires/cornéennes pouvant aboutir à une perte de vision. En outre, des encéphalites (inflammation du cerveau, ndlr) ont été décrites.
Jean Marc Zokoé, Fourni par l’auteur
Les enfants sont plus souvent victimes de complications et ont de fait une mortalité plus élevée que les adultes. On suppose que les personnes immunodéprimées (notamment les individus séropositifs pour le VIH) ont aussi un risque plus important de développer des formes graves, mais les données manquent encore pour pouvoir l’affirmer avec certitude. Lors de l’épidémie au Nigéria, 4 personnes sur les 7 décédées étaient séropositives.
La prise en charge de la maladie est essentiellement symptomatique : désinfection des lésions, administration d’antibiothérapie en cas de surinfection, réhydratation… Certaines molécules antivirales sont actuellement en cours d’évaluation d’efficacité sur la variole du singe (le tecovirimat notamment), mais les résultats ne sont pas encore disponibles.
TC : Est-ce la première fois que ce virus se propage au-delà du continent africain ? Combien de cas ont été recensés jusqu’ici, et où ?
CB : Non, ce n’est pas la première fois. Si la souche du bassin du Congo n’a jamais quitté l’Afrique, en revanche la souche ouest-africaine a déjà fait une incursion aux États-Unis en 2003, suite à l’importation d’animaux infectés. Plus récemment, plusieurs cas humains importés ont également été déclarés dans divers pays.
En 2003, les malades américains avaient été contaminés suite à un contact avec des chiens de prairie infectés, achetés dans des animaleries où ils avaient côtoyé des rats de Gambie (Cricetomys gambianus) importés du Ghana et porteurs du monkeypox. On avait dénombré 47 cas humains suspects, résultant de transmission de l’animal à l’humain (transmission dite « zoonotique »). Aucune transmission interhumaine n’avait eu lieu. À l’époque, les autorités américaines s’étaient inquiétées du risque d’installation du virus au sein d’un réservoir animal autochtone, mais cela ne s’était pas produit.
En 2017, une flambée plus importante s’est produite au Nigéria, un pays qui n’avait enregistré aucune épidémie de variole du singe depuis 40 ans. Cette épidémie dure encore aujourd’hui, alimentée par des transmissions zoonotiques et interhumaines sporadiques et régulières. Un peu plus de 500 cas suspects ont été déclarés à ce jour (parmi lesquels 215 confirmés). Point rassurant : en 5 ans, seuls 8 décès ont été déplorés.
Cette épidémie nigériane a cependant changé la donne. En effet, alors qu’auparavant le virus sévissait plutôt dans des régions forestières peu connectées au reste du pays et du monde, il a atteint en 2017 les zones urbaines du Nigéria, d’où il a pu plus facilement essaimer hors du continent. Conséquence : en 2018 plusieurs cas sont survenus à Singapour, en Israël, et en Angleterre, chez des voyageurs revenant du Nigéria.
Dans ce dernier pays, une transmission autochtone s’est produite : une aide-soignante britannique s’est contaminée en nettoyant le lit d’un patient. L’épidémie ne s’était pas propagée, mais d’autres cas ont ensuite émergé au Royaume-Uni en 2021, à nouveau en lien avec des voyageurs de retour du Nigéria, ainsi qu’aux États-Unis (deux cas déclarés).
TC : En quoi le contexte actuel est-il différent ?
CB : La situation est très différente. Certes, le premier cas de l’épidémie actuelle, survenu le 7 mai au Royaume-Uni, était un voyageur de retour du Nigéria. Mais depuis, plusieurs autres cas ont été confirmés au Royaume-Uni sans qu’on puisse établir de lien ni avec le cas du 7 mai ni entre eux. Aucun voyage à l’étranger compatible avec une contamination n’a pu être mis en évidence, et les chaînes de transmission directes n’ont pu être établies. Cette situation suggère qu’il existe plusieurs chaînes de transmission et une circulation autochtone du virus.
Depuis le 18 mai, des cas ont aussi été détectés en Espagne (7 cas confirmés, 16 cas suspects), au Portugal (5 cas confirmés et 15 cas suspects), en Suède (1 confirmé), en Italie (1 confirmé, 2 suspects), en Belgique (1 confirmés, 2 suspects), au Canada (12 cas suspects à Montréal), en Australie (1 cas confirmé, 1 cas suspect), en Allemagne et en Belgique. Un cas a aussi été confirmé aux États-Unis (cette personne avait récemment voyagé au Canada). En France, un cas suspect a été rapporté par la Direction générale de la Santé le 19 mai.
Jusqu’ici toutes ces infections se sont avérées peu sévères. Sur les 80 cas confirmés et la cinquantaine de cas suspects, une dizaine de patients sont actuellement hospitalisés en Europe, mais plutôt dans une perspective d’isolement qu’en raison d’une gravité clinique.
Cette circulation autochtone de la maladie est complètement nouvelle. Autre nouveauté : ces cas concernent quasi uniquement des hommes jeunes, se déclarant, pour une majorité d’entre eux, comme ayant des relations sexuelles avec d’autres hommes. Un cas chez une femme a été annoncé en Espagne le 20 mai 2022.
TC : En quoi est-ce une nouveauté ? Quels sont les modes de contamination habituels ?
CB : Les épidémies de variole du singe débutent habituellement par une transmission de l’animal à l’être humain, même si l’on en ignore les détails, et que jamais une même souche virale n’a été isolée chez un animal et un humain. Il pourrait s’agir de contact direct avec un animal vivant, pendant la chasse, ou lors de la consommation de viande de brousse.
Plus spécifiquement, dans le cadre de la recherche que nous menons en RCA, on constate une recrudescence saisonnière des épidémies faisant évoquer un lien avec certaines activités saisonnières, telles que la collecte de chenilles comestibles en forêt, suggérant une exposition à la faune locale lors de ces collectes.
Bien que des scientifiques traquent le réservoir de ce virus depuis les années 1970, il n’a été isolé chez des animaux sauvages qu’à 5 reprises jusqu’à aujourd’hui : en 1985 en République Démocratique du Congo chez un écureuil, le Funisciure à dos rayé (Funisciurus anerythrus, que l’on suspecte être le réservoir du monkeypox), puis en 1992 chez un singe mangabey (Cercocebus atys) en Côte d’Ivoire, et enfin, deux décennies plus tard, chez le rat de Gambie et un autre rongeur (Stochomys longicaudatus), ainsi que chez un autre Funisciure (Funisciurus bayonii). À l’heure actuelle, les principaux suspects sont donc les rongeurs, dont les écureuils.

cherifikoukomon, CC BY-NC
Fait intéressant, le monkeypox a été isolé sur des faeces de chimpanzés, dans le parc National Taï en Côte d’Ivoire, lors d’une épidémie chez les primates, suggérant la possibilité d’une contamination environnementale.
Au-delà de la transmission zoonotique, une transmission interhumaine se produit, suite à un contact direct et prolongé avec des malades, avec leurs fluides corporels ou en touchant des surfaces contaminées (vêtements, literie, surfaces…), la plupart du temps au sein du foyer.
Une transmission par gouttelettes respiratoires est aussi évoquée, mais ce point est difficile à établir clairement. En effet, les contaminations se produisent généralement au sein de familles, où la proximité est étroite et les modes de contacts nombreux et variés. En Afrique, des transmissions nosocomiales ont aussi été documentées.
Lors de la description détaillée des cas de l’épidémie du Nigéria de 2017, la forte proportion d’atteintes génitales (68 %) a pour la première fois fait suspecter une potentielle transmission par contacts rapprochés lors des rapports sexuels. Cette proportion est également très élevée pour les cas en RCA pour lesquels nous disposons de cette donnée.
Les contacts intimes et rapprochés lors de rapports sexuels expliqueraient la facilitation d’une transmission interhumaine d’un virus connu habituellement comme peu transmissible. Cette hypothèse semble appuyée par le fait que – pour l’instant – les cas « hors Afrique » de ces dernières semaines concernent majoritairement des hommes jeunes ayant des rapports avec d’autres hommes, ou se définissant comme homosexuels. Précisons que cette transmission pourrait survenir également lors de rapports hétérosexuels.
TC : Doit-on craindre une forte dissémination de cette maladie ? Comment faire pour la limiter ?
CB : Pour l’instant, on ne peut avoir aucune certitude sur ce qui va advenir. Le problème, ce sont ces nouveaux cas qui ne correspondent encore à aucune chaîne de transmission définie. Comme le montre l’évolution quotidienne et en raison d’une incubation relativement longue, le risque est réel que de nouvelles infections se déclarent dans les pays déjà touchés ou dans d’autres pays au cours des prochains jours ou des prochaines semaines. Plusieurs cas survenus en Espagne et en Italie apparaissent en lien avec un évènement festif sur les îles Canaries entre le 5 et le 15 mai, ayant rassemblé 80 000 personnes, et ayant pu jouer le rôle d’évènement propagateur. De la même façon, en Espagne, pays présentant le plus grand nombre de cas à ce jour, un sauna dans la capitale semble avoir été un foyer de contaminations.
Afin de limiter la propagation du virus, il faut sensibiliser et informer les communautés et personnes concernées ainsi que les médecins, afin d’identifier rapidement tous les cas et retracer leurs contacts. Une difficulté pour les médecins est que les lésions ressemblent à celles de la varicelle, et que les lésions génitales peuvent être confondues avec les symptômes de certaines MST (syphilis, herpès…). Un test PCR et l’isolement du virus permettent de confirmer le diagnostic, mais seuls certains laboratoires spécialisés sont équipés pour mener ce type d’analyses.
Un point plutôt rassurant est que les épidémies de variole du singe s’éteignent assez vite spontanément. La chaîne de transmission la plus longue identifiée s’étendait sur 7 générations, autrement dit 7 humains se passent consécutivement la maladie avant que la transmission ne s’arrête.
Les raisons de cette extinction spontanée de la propagation sont mal comprises. Une hypothèse est que ces épidémies surviennent jusque-là dans de petits villages, au sein de communautés de taille limitée avec certains individus potentiellement déjà immunisés : le virus ne contamine alors que les gens qui n’ont jamais été en contact avec lui. L’épidémie de 2003 aux États-Unis s’était aussi arrêtée rapidement, sans contamination interhumaine secondaire.
À suivre cette fois-ci…
TC : Le vaccin contre la variole pourrait-il être utilisé contre ce virus ?
CB : On sait que l’infection naturelle par le virus de la variole confère une protection croisée contre la variole du singe. Dans les années 1980, il avait été montré que le vaccin contre la variole conférait lui aussi une protection croisée, estimée à 85 %. Cependant, ces estimations ont été faites quelques années seulement après les campagnes de vaccination massive visant l’éradication de la variole. Actuellement, on considère que l’efficacité tourne plutôt autour de 65 %.
Par ailleurs, la vaccination antivariolique a été suspendue dans les années 1980, après l’éradication de la maladie. Aujourd’hui seuls certains personnels de santé sont encore vaccinés (pour être en capacité de répondre à un risque bioterroriste – le virus restant stocké sous haute surveillance dans certains laboratoires). La première génération de vaccin antivariolique n’est plus utilisée, en raison d’effets indésirables importants.
Pour l’instant, le vaccin le plus à même d’être déployé si nécessaire est un vaccin dit « de 3e génération », Imvamune (ou Imvanex). Il s’agit d’un vaccin atténué, toutefois, contrairement aux vaccins plus anciens, il peut être administré aux personnes immunodéprimées. Il a déjà été utilisé en Israël, à Singapour, et au Royaume-Uni chez des personnels de santé et les contacts des cas importés. Son efficacité est actuellement en cours d’évaluation en RDC, chez les personnels de santé.
Des vaccins de 4e génération sont aussi en cours de développement. Il s’agit de vaccins « sous-unitaires », qui ne contiennent plus de virus atténué, mais uniquement des fragments. Leur efficacité est aussi en cours d’évaluation.
Le vaccin peut être utilisé non seulement en pré-exposition (administration avant la rencontre avec le virus), mais également en post-exposition. Aux États-Unis, la recommandation est de l’administrer de préférence dans les 4 jours post-exposition, et jusqu’à 14 jours.
TC : Risque-t-on de voir émerger d’autres variants du monkeypox ? Le génome du virus qui circule actuellement en Europe est-il rigoureusement le même que celui de la souche ouest-africaine ?
CB : Le monkeypox étant un virus à ADN, il est moins susceptible de muter que des virus à ARN comme le SARS-CoV-2.
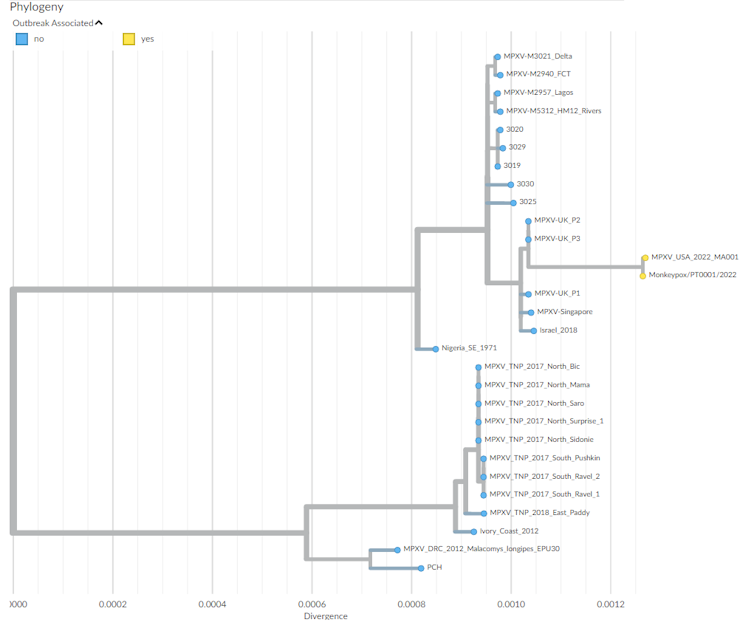
Il est assez facile de déterminer si on a affaire à la souche d’Afrique de l’Ouest ou à celle du bassin du Congo : il suffit pour cela de séquencer de courtes séquences spécifiques de son ADN. En revanche, étant donné la grande taille du génome de ce virus, il est plus long et fastidieux d’obtenir une séquence complète, ce qui est nécessaire pour détecter plus finement les différences de séquences, et ainsi établir les chaînes de transmission et les liens entre les cas. Mais l’expérience du SARS-CoV-2 nous a prouvé qu’une mobilisation générale pouvait accélérer grandement les choses…
Nextrain.org
Les premiers séquençages effectués chez un patient portugais et un patient belge mettent en évidence d’une part la proximité génétique de ce virus avec ceux isolés au Nigéria et lors des précédentes exportations de 2018, et la similarité des deux génomes, évoquant une transmission communautaire en Europe. D’autres séquençages sont nécessaires pour répondre à toutes les interrogations persistantes, et notamment pour voir si une adaptation du génome est en cours et cela vers une transmissibilité plus grande du virus. Pour l’instant, il n’y a pas d’éléments qui vont dans ce sens.
TC : Afin de mieux comprendre la variole du singe et ses dynamiques de circulation. l’Institut Pasteur et ses partenaires en France et en RCA ont mis en place en 2019 le projet Afripox. En quoi consiste-t-il ?
CB : Ce projet transdisciplinaire a été mis en place après qu’Emmanuel Yandoko Nakoune, qui dirige le laboratoire des arbovirus, fièvres hémorragiques, virus émergents et zoonoses à l’Institut Pasteur de Bangui en RCA a signalé une augmentation du nombre d’épidémies de variole du singe dans le pays.
Plus largement, durant les dernières décennies, il a été constaté une augmentation du nombre et de la fréquence des épidémies de variole du singe en Afrique, ainsi qu’une expansion vers des zones où la maladie n’était pas endémique. L’amélioration de la surveillance et la diminution de l’immunité (la vaccination antivariolique a été arrêtée en 1980) contribuent probablement à cette augmentation, cependant celle-ci semble aussi refléter une circulation virale accrue, dans une région du monde qui connaît des perturbations écologiques majeures.
Devant le grand nombre d’inconnues autour de l’épidémiologie de la variole du singe, l’idée de ce projet était de s’appuyer sur la surveillance nationale déjà en place en RCA pour développer une approche One Health de la variole du singe en s’intéressant à ses aspects épidémiologique, écologique, zoologique, anthropologique et virologique.
En partenariat avec des chercheurs du Muséum national d’histoire naturelle, nous tentons par exemple d’identifier son réservoir animal. Avec l’équipe du SESSTIM à Marseille, nous explorons l’écologie de la maladie afin de comprendre par exemple ce qui explique sa répartition plutôt forestière, de cerner l’impact de la déforestation sur les épidémies, de déterminer s’il existe une saisonnalité, etc.

Jean Marc Zokoé, Author provided
La mise au point de tests PCR diagnostics utilisables sur le terrain, par l’équipe de la Cellule d’Intervention Biologique d’Urgence (Cibu) à l’Institut Pasteur de Paris, est également un des buts d’Afripox (actuellement, les échantillons suspects sont analysés à Bangui). Cela permettrait de réduire le délai de confirmation et de faciliter la mise en place rapide de mesures appropriées.
Enfin, les aspects épidémiologiques et anthropologiques sont explorés par les équipes de l’Institut Pasteur Paris (Unité d’épidémiologie des maladies émergentes et unité Anthropologie et écologie de l’émergence des maladies), en collaboration avec les chercheurs locaux, afin de déterminer plus précisément quels sont les facteurs de risque de transmission zoonotique ou interhumaine, et pourquoi la variole du singe est en augmentation depuis les années 1980. En effet, s’il est essentiel de comprendre la dynamique de cette nouvelle épidémie à propagation interhumaine et sa présentation relativement inédite, la compréhension de l’émergence et de la circulation de la variole du singe sur son continent d’origine est tout aussi fondamentale.
Lorsqu’Afripox a été mis en place, voici 3 ans, peu de gens imaginaient que cette maladie risquait un jour de quitter le continent africain pour se disséminer sur la planète. L’épidémie actuelle souligne une nouvelle fois l’importance d’investir dans la recherche scientifique sur le temps long, afin de se préparer à toutes les éventualités…![]()
Camille Besombes, Médecin infectiologue en thèse d’épidémiologie – Unité d’épidémiologie des maladies émergentes, Institut Pasteur et Arnaud Fontanet, Médecin, directeur de l’Unité d’épidémiologie des maladies émergentes à l’Institut Pasteur de Paris, professeur de santé publique, Conservatoire national des arts et métiers (CNAM)
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.





